Rudolf A. Marcus
Doctor Honoris Causa per la Universitat Politècnica de València. Investit el 22 de juny de 1999
Discurs
És un honor per a mi rebre el títol de doctor honoris causa de la seua distingida Universitat. Durant la major part de la meua vida com a professor he estat associat amb institucions tècniques, ja que vaig obtenir el meu primer lloc acadèmic al Polytechnic Institute of Brooklyn i més endavant -el meu lloc actual al California Institute of Technology. De manera que ací, a la Universitat Politècnica de València, em sent com a casa i estic orgullós de ser honrat per aquesta Universitat.
M'agradaria recordar, a més, la bona relació que he tingut amb col·legues espanyols. N'hi ha que han anat al meu laboratori per investigar i he coincidit amb d'altres en congressos o escoles d'estiu. Els dec molt per les seues idees estimulants i per la seua amistat calorosa. Voldria aprofitar aquesta oportunitat per a descriure breument la meua investigació, i també la d'altres científics. Desitge d'aquesta manera descriure l'evolució d'un camp de ciència, el de la química, durant l'últim mig segle. És un exemple de com una àrea diminuta d'estudi escolàstic que comença com un rierol pot evolucionar en el futur a un diluvi de moltes idees i àrees d'investigació molt diferents.
El camp d'investigació de què parlaré avui és el de transferència d'una partícula elemental, un electró, d'una molècula (donant) a una altra (receptor). La transferència pot ocórrer en un líquid, en una membrana biològica, o en un sòlid. Aquesta transferència d'electró provoca el canvi de la naturalesa química tant del donant com del receptor i és àmpliament present tant en la natura com en els dispositius artificials. Aquesta transferència participa en un pas important en el cicle pel qual les plantes usen l'energia solar i produeixen oxigen a partir de diòxid de carboni i aigua. Té una funció en la respiració dels humans i d'altres éssers vius i també en molts altres processos com ara la corrosió de metalls, l'emissió de llum de les lluernes o a través de lightsticks químics, en elfuncionament de bateries de cotxes, i fins i tot proporciona el color a algunes pedres precioses. En mostraré exemples més endavant. Avui m'agradaria descriure'ls com va evolucionar la ciència durant l'últim mig segle en el camp de transferència electrònica i què és el que podem aprendre a partir d'això.
Aquest camp va renàixer poc després de la fi de la Segona Guerra Mundial. En aquell moment els isòtops radioactius de molts àtoms eren fàcilment accessibles. Els químics els van usar com a marcadors per a estudiar els mecanismes de diferents reaccions químiques, com les que permeten a les plantes usar diòxid de carboni per al seu creixement (Calvin, per exemple, va rebre més tard el Premi Nobel en Química per aquest treball). Libby el va rebre pel seu treball sobre el traçat de carbó radioactiu que va trobar innumerables aplicacions en arqueologia i antropologia. Hi havia també altres pioners.
Un exemple de reacció química que inclou transferència d'electrons és el de dues molècules carregades ( ions ) en aigua:
Fe2+* + Fe3+ ®< Fe3+* + Fe2+
(ferrós* + fèrric ® fèrric* + ferrós )
En què l'asterisc marca un àtom radioactiu que es troba en mínima proporció (traces). La reacció inclou la transferència d'un electró de l'ió ferrós al fèrric. La velocitat de la reacció es valora separant físicament els dos reactants en diferents moments de la reacció, per exemple precipitant físicament l'ió fèrric fóra de la solució i analitzant el nivell radioactiu d'aquest precipitat.
Es van estudiar moltes d'aquestes reaccions de transferència d'electrons en molts tipus d'elements i compostos químics. Aquests estudis van tenir unes conseqüències inesperades i de molta transcendència, malgrat que les reaccions d'intercanvi isotòpic només eren una petita part de la química.
Una raó per a aquestes conseqüències inesperades és que les reaccions d'intercanvi isotòpic de transferència d'electrons representen el tipus més simple de totes les reaccions químiques. Són el tipus més simple per diverses raons. Els productes finals de la reacció són els mateixos que els inicials, l'única excepció és la posició del marcador radioactiu. Aquest detall significa que un dels factors més importants que influeixen en la velocitat d'una reacció química, l'estabilitat dels productes enfront dels reactants, ací no hi és. (En termes tècnics, "l'energia lliure estàndard de la reacció", G0, és igual a zero). A més, cap enllaç químic no es trenca en simples transferències electròniques. Per això, els químics que van estudiar aquestes reaccions van poder dirigir l'atenció cap a altres factors que influeixen en la velocitat de la reacció, factors que sovint estan emmascarats per l'efecte de G0 i la ruptura d'enllaços químics.
A partir d'aquests estudis va aparéixer un patró: quan els canvis en longituds d'enllaços químics del reactant eren grans a causa de la transferència electrònica, o quan els ions que reaccionaven eren petits, la velocitat de la reacció també era petita, menor en diversos ordres de magnitud, no una proporció numèrica petita. Per a interpretar aquest efecte, Libby va assenyalar que quan l'electró salta del donant a l'acceptor, ho fa tan ràpidament que els lents nuclis atòmics que determinen les longituds d'enllaç i l'orientació de molècules de dissolvent no tenen temps per a ajustar-se a la instantània nova distribució de càrrega iònica. D'aquesta manera va poder explicar per què la barrera energètica de la reacció és més gran per als reactants que tenen més diferència de longitud d'enllaços (com la diferència entre les longituds d'enllaç Fe-O en aigua, entre Fe(H2O)6+2 i Fe(H2O)6+3 o una diferència fins i tot més gran en la polarització dielèctrica del dissolvent que rodeja cada ió. Aquesta diferència de polarització dielèctrica augmenta en disminuir la grandària de cada ió, perquè un ió més petit crea un camp elèctric més gran).
La dinàmica idea de Libby va proporcionar un salt en la nostra concepció. Tanmateix, vaig comprendre que hi havia un error. Aquesta idea meravellosa violava la llei de conservació d'energia! Es va veure clarament que la resposta a aquest enigma estava en el fet que alguns dels canvis en la longitud d'enllaç i d'orientació de molècules solvents havien d'ocórrer abans de la transferència electrònica, en lloc d'ocórrer tots després. Basant-me en aquesta idea vaig poder calcular la nova barrera energètica de la reacció i obtenir equacions teòriques simples per a la transferència electrònica en diferents processos.
Mentrestant, el camp d'investigació de transferència electrònica moderna va començar a estendre's més enllà de la seua estreta base, en part a causa del desenvolupament de tecnologia electrònica i altres tecnologies. Els sistemes de flux ràpid per a l'estudi de reaccions es van fer accessibles, igual que els llums de flaix i altres fonts pulsatives de llum per a l'estudi de transferències electròniques i altres reaccions químiques. Al mateix temps que aquests avanços, hi hagué un gran desenvolupament de circuits electrònics per a l'estudi de reaccions ràpides de transferència d'electrons en electroquímica, de manera particular les reaccions de transferència electrònica en elèctrodes metàl·lics i semiconductors i en altres interfícies.
Usant la informació obtinguda de les reaccions d'intercanvi isotòpic d'una banda, i la teoria que es va desenvolupar a partir d'ací d'altra banda, es va crear una excitant col·laboració entre els científics pràctics i teòrics a partir dels anys cinquanta. Com a conseqüència, es van desenvolupar estudis de transferència d'electrons en diferents sistemes biològics. S'ha deduït una única equació per a la velocitat de transferència electrònica, no la mostraré ací a pesar de la seua simplicitat, que va explicar amb èxit moltes de les dades experimentals. És aplicable a la majoria dels fenòmens descrits en la figura 1 d'aquesta conferència. En la nostra era informatitzada és fàcil oblidar els grans avantatges de l'ús, quan és possible, d'equacions teòriques que relacionen uns fenòmens amb d'altres. Quan es pot desenvolupar aquesta classe de teoria, la visió global que les equacions i els conceptes poden donar a l'experimentador és immensa. Però, per descomptat, no tots els problemes tenen una solució tan senzilla.

Durant l'últim mig segle els investigadors en el camp de reaccions de transferència electrònica han incrementat àmpliament la seua habilitat de mesurar la velocitat de les reaccions en diferents escales de temps. Van ser capaços de reduir el temps d'estudi de les reaccions pel factor de milió de milions de vegades, el factor 10 12! La tecnologia làser va tenir un paper important en aquest dramàtic canvi en l'habilitat d'observar les ràpides reaccions químiques.
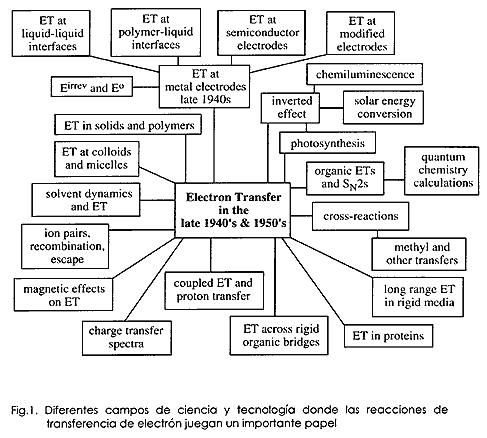
No crec que cap dels qui treballàvem en el camp de transferència d'electrons en aquells primers temps ens imaginàrem que aquest tema es desenvoluparia des d'una diminuta llavor de l'estudi de reaccions d'intercanvi isotòpic fins a l'extensa àrea que avui inclou; l'exemple d'aquest creixement es mostra a la figura 1. Aquest increïble creixement es deu en part a l'ús de les noves tecnologies, en part al gran nombre de temes en què la transferència electrònica té una funció important, i en part a la interacció fructífera entre els científics pràctics i teòrics. Però el gran desenvolupament mostrat a la figura 1 no va ser anticipat per ningú. (Fig. 1).
Diferents camps de ciència i tecnologia en què les reaccions de transferència d'electró tenen un paper important
M'agradaria concloure aquesta conferència amb alguns esquemes que descriuen les aplicacions de transferència d'electrons en diferents aspectes de la vida humana. Són presos d'un pòster preparat a Suècia durant la Setmana de Premis Nobel i dissenyat per a explicar a un cercle ampli d'oients la naturalesa de la investigació per a la qual es va atorgar el premi aquell any.
La primera transparència és la descripció de la fotosíntesi en plantes. (fig. 2)

La segona descriu la reacció química més simple, una transferència electrònica. (fig. 3)

La tercera descriu l'oxidació de metalls. (fig. 4)

La quarta descriu el color de les pedres precioses. (fig. 5)

La següent mostra la transferència electrònica en matèria viva, (fig. 6)
Mentre que l'última descriu els bastonets lluminosos químics i parla un poc sobre la teoria.
Va ser una ocasió feliç que ha deixat records duradors sobre tot el que ocorre.
Tel. (+34) 96 387 70 00






